In první část tohoto článku, Zkontroloval jsem smluvní a regulační rámec aplikovaný vládou USA na počáteční vývoj, výrobu a akvizici injekcí mRNA Covid s použitím dohod BioNTech/Pfizer pro ilustraci procesu.
Prokázal jsem, že těmto produktům bylo uděleno povolení k nouzovému použití (EUA) na základě klinických zkoušek a výrobních procesů prováděných s
- žádné závazné právní normy,
- žádný zákonem zakázaný bezpečnostní dohled nebo regulace, a
- žádné právní odškodnění ze strany výrobce za případné škody.
V tomto navazujícím článku poskytnu podrobnou analýzu podkladové dokumentace.
Další transakční autorita/dohoda (OTA): Vojenská akviziční cesta
Projekt dohoda mezi americkou vládou zastoupenou ministerstvem obrany (DoD) a společností Pfizer, zastupující partnerství BioNTech/Pfizer, v červenci 2020 na nákup „vakcíny k prevenci COVID-19“ nebyla běžná akviziční smlouva.
Jednalo se o dohodu pod Other Transaction Authority (OTA) – akviziční cestu, která podle Pokyny ministerstva obrany, se od roku 1958 používá k „povolení vstupu federální agentury jiné transakce než smlouvy, granty nebo dohody o spolupráci. "
[Přidána BOLDFACE]
Důkladný přehled používání OTA ministerstvem obrany, včetně jeho statutární historie, lze nalézt v Zpráva Kongresové výzkumné služby z 22. února 2019. Tato zpráva spolu s každou další diskusí o OTA uvádí, že se jedná o alternativní cestu akvizice pro obranné a vojenské účely. Není určen a ani nebyl nikdy před Covidem použit k ničemu určenému primárně pro civilní použití.
Pokud hledáte Zákony OTA v kodexu USA, toto je cesta, kterou půjdete:
Ozbrojené síly -> Všeobecné vojenské právo -> Akvizice -> Výzkum a inženýrství -> Smlouvy -> Oprávnění ministerstva obrany provádět určité prototypové projekty
Tato právní cesta velmi jasně ukazuje, že zákony OTA jsou určeny pro pořizování výzkumných a inženýrských prototypů pro ozbrojené síly.
Ministerstvo obrany má pravomoc pro tři různé typy OT: (1) výzkumné OT, (2) prototypové OT a (3) produkční OT.
Tyto tři typy OT představují tři fáze počátečního výzkumu, vývoje prototypu a případné výroby.
V rámci těchto tří typů existují specifické kategorie projektů, na které se OTA může vztahovat:
- Původně, podle Přehled OTA poskytnutý ministerstvem obrany byl orgán pro jiné transakce „omezený na použití na zbraně nebo zbraňové systémy, které ministerstvo obrany navrhlo k získání nebo vyvinutí“.
- OTA byla později rozšířena tak, aby zahrnovala „jakýkoli prototypový projekt přímo související se zvýšením efektivity mise vojenského personálu a podpůrných platforem, systémů, komponentů nebo materiálů navržených k získání nebo vyvinutí ministerstvem obrany, nebo se zlepšením platforem, systémů, komponentů. nebo materiály používané ozbrojenými silami."
Nic z toho zatím nezní jako cesta k získání milionů nových zdravotnických produktů určených především pro civilní použití.
Existuje nějaká výjimka pro civilní použití OTA, která by se mohla vztahovat na vakcíny Covid mRNA?
Projekt FY2004 National Defense Authorization Act (PL 108-136) obsahovala část, která přidělovala autoritu pro jiné transakce „vedoucímu výkonné agentury, která se zabývá základním výzkumem, aplikovaným výzkumem, pokročilým výzkumem a vývojovými projekty“, které „mají potenciál usnadnit obranu proti terorismu nebo zotavení se z terorismu nebo jaderného, biologického, chemický nebo radiologický útok."
Toto ustanovení bylo prodlouženo do roku 2018, ale nezdá se, že by bylo prodlouženo po tento rok. Také si uvědomte, že i v tomto výjimečném případě použití non-DoD OTA, situace musí zahrnovat terorismus nebo útok zbraněmi hromadného ničení (CBRN).
Jaké další zákony OTA mohou platit?
Výše uvedená zpráva CRS z roku 2019 poskytuje tento graf, který ukazuje, že několik agentur, které nejsou DoD, má nějaké OTA nebo související orgány:
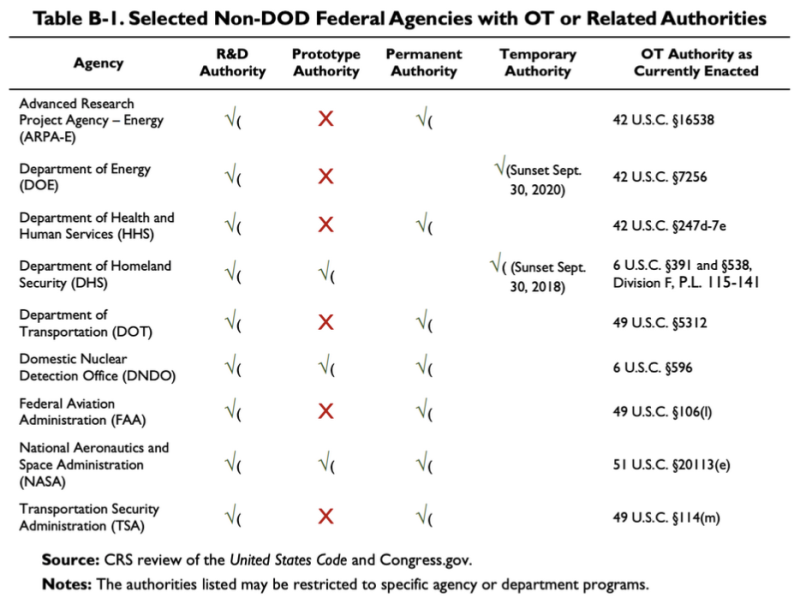
Podle této tabulky má Ministerstvo zdravotnictví a sociálních služeb (HHS) některé orgány pro výzkum a vývoj (R&D) Jiné transakční orgány. Zákon týkající se OT autorita HHS je 42 U.S.C. §247d-7e.
Kde je tento zákon uložen a co říká?
Veřejné zdraví a sociální péče -> Veřejné zdravotnictví -> Všeobecné pravomoci a povinnosti -> Spolupráce federálních států -> Úřad pro pokročilý biomedicínský výzkum a vývoj (BARDA) -> Transakční úřady
Takže v zákoně týkajícím se civilního zdraví a sociální péče je místo, kde by se OTA mohla použít, i když je platná pouze pro výzkum a vývoj, nikoli prototypy nebo výrobu.
Zákon stanoví, že sekretář BARDA má pravomoc OT
s ohledem na produkt, který je nebo se může stát a kvalifikované protiopatření nebo kvalifikovaný pandemický nebo epidemický produkt, činnosti, které převážně —
i) jsou prováděny po základním výzkumu a předklinickém vývoji přípravku; a
(ii) souvisejí s výrobou produktu v obchodním měřítku a ve formě, která splňuje regulační požadavky podle Federal Zákon o potravinách, léčivech a kosmetice [21 USC 301 a násl.] nebo pod oddíl 262 této hlavy.
[Přidána BOLDFACE]
„Regulační požadavky“ vyjmenované v zákoně znamenají, že pro BARDA/HHS by nebylo možné uzavírat dohody – i jen o výzkumu a vývoji – pro jakékoli lékařské produkty (jako jsou mRNA vakcíny), které neprošly přísným bezpečnostním testováním a přísným výrobním dohledem.
HHS „Partnerství“ s DoD obcházelo zákony o civilní ochraně
Abychom shrnuli nesnáze týkající se jiných transakčních autorit/dohod, pokud jde o civilní orgány obecně, a zejména o vakcíny Covid mRNA:
- OTA byla napsána a kodifikována jako způsob, jakým armáda získá zbraně a další potřebné systémy a vybavení bez velké byrokratické byrokratické zátěže. Zahrnuje výzkum a vývoj, prototypy a následnou výrobu.
- Jediný OTA pro agenturu veřejného zdraví je pro HHS a pokrývá pouze výzkum a vývoj, nikoli prototypy nebo výrobu.
- Dokonce i R&D OTA udělené HHS stále vyžaduje, aby byly produkty vyráběny „ve formě, která splňuje regulační požadavky“ na bezpečnost léčiv a vakcín.
Jinými slovy: Neexistuje žádný způsob, jak by HHS mohla využít své velmi omezené OTA k podpisu smluv na stovky milionů nových lékařských produktů.
Co tedy HHS udělal?
Jak ve svém prohlášení uvedl Úřad pro vládní odpovědnost (GAO). Zpráva z července 2021 o „Covid-19 Contracting:“ HHS „spolupracoval“ s DoD, aby „využil autority OTA ministerstva obrany… které HHS postrádalo“. (str. 24)
Jaké jsou OT autority DoD pro lékařské produkty?
Jak již bylo řečeno, OTA má pomoci armádě získat vybavení a technologie bez spousty byrokratických potíží. Žádný z původních zákonů týkajících se OTA nezmiňoval nic jiného než „platformy, systémy, komponenty nebo materiály“, které měly „zvýšit efektivitu mise vojenského personálu“.
Ale pět let před Covidem bylo představeno výjimečné použití OTA:
V 2015, DoD oznámil založení CBRN Medical Countermeasure Consortium, jehož účelem bylo využít cestu akvizice OTA ke „spolupráci s DoD na vývoji chemických, biologických, radiologických a nukleárních lékařských protiopatření s licencí FDA“. [FDA = Food & Drug Administration]
Jak je popsáno v oznámení z roku 2015, zahrnovalo to „prototypové technologie pro terapeutická lékařská protiopatření zaměřená na virové, bakteriální a biologické toxinové cíle, které jsou předmětem zájmu ministerstva obrany“. Seznam agentů zahrnoval hlavní patogeny biologické války, jako je antrax, ebola a marburg.
Oznámení dále upřesňuje, že „technologie mohou zahrnovat zvířecí modely virového, bakteriálního nebo biologického toxinového onemocnění a patogeneze (více cest expozice), testy, diagnostické technologie nebo jiné platformové technologie, které lze použít k vývoji schválených nebo licencovaných MCM. [lékařská protiopatření]."
Ačkoli to stále nezní nic jako výroba 100 milionů nových vakcín pro civilní použití, poskytuje to OTA větší prostor než velmi omezený orgán pro jiné transakce, který má HHS.
Zatímco HHS OTA vyžaduje dodržování rozsáhlých vývojových a výrobních předpisů, cesta OTA pro ministerstvo obrany k vývoji lékařských protiopatření vyžaduje pouze „licenci FDA“.
S využitím DoD Other Transaction Authorities by tedy teoreticky bylo možné obejít jakékoli bezpečnostní předpisy – v závislosti na požadavcích na licencování FDA produktu generovaného OTA. Jak uvidíme, v případě vakcín Covid mRNA bylo uděleno povolení k nouzovému použití, které nevyžaduje vůbec žádný právní dohled nad bezpečností.
Nouzové povolení k použití (EUA)
Zde je návod, jak Food & Drug Administration (FDA) popisuje své EUA pravomoci:
§ 564 zákona FD&C (21 U.S.C. 360 bb–3) umožňuje FDA posílit ochranu veřejného zdraví proti biologickým, chemickým, jaderným a radiologickým látkám.
S touto autoritou EUA může FDA pomoci zajistit, že lékařská protiopatření mohou být použita v naléhavých případech k diagnostice, léčbě nebo prevenci závažných nebo život ohrožujících onemocnění nebo stavů způsobených biologickými, chemickými, nukleárními nebo radiologickými látkami, pokud neexistují adekvátní, schválená a dostupné alternativy (kromě jiných kritérií).
Je nesmírně důležité pochopit, že tyto pravomoci EUA byly uděleny v roce 2004 za velmi specifických okolností souvisejících s připraveností na útoky zbraněmi hromadného ničení, jinak známými jako CBRN (chemické, biologické, radiologické, jaderné) látky.
Jak bylo vysvětleno v Harvard Law’s Bill of Health,
Nakonec to byla válka proti terorismu, která dala vzniknout povolení k nouzovému použití. Po událostech z 11. září 2001 a následných antraxových poštovních útocích Kongres uzákonil Project Bioshield Act z roku 2004. Zákon požadoval miliardy dolarů na nákup vakcín v rámci přípravy na bioteroristický útok a na hromadění nouzových protiopatření. Aby bylo možné rychle jednat v případě nouze, povolil Kongres FDA povolit formálně neschválené produkty pro nouzové použití proti ohrožení veřejného zdraví a bezpečnosti (s výhradou vyhlášení nouzového stavu ze strany HHS). The záznam naznačuje, že Kongres se zaměřil konkrétně na hrozbu bioteroru, nikoli na přípravu na přirozeně se vyskytující pandemii.
Projekt znění zákona EUA zdůrazňuje skutečnost, že byl určen pro použití v situacích zahrnujících zbraně hromadného ničení. Zde jsou 4 situace, ve kterých lze vydat EUA:
- rozhodnutí ministra pro vnitřní bezpečnost, že existuje domácí nouzový stav nebo významný potenciál pro domácí nouzový stav, který zahrnuje zvýšené riziko útoku biologickým, chemickým, radiologickým nebo jaderným činitelem nebo látkami;
- rozhodnutí ministra obrany, že existuje vojenská mimořádná situace nebo významný potenciál pro vojenskou mimořádnou událost, která zahrnuje zvýšené riziko pro United States vojenské síly, včetně personálu působícího pod pravomocí hlavy 10 nebo hlavy 50, zaútočí s —
- biologické, chemické, radiologické nebo jaderné činidlo nebo činidla; nebo
- agent nebo agenti, kteří mohou způsobit nebo jsou jinak spojeni s bezprostředně život ohrožujícím a specifickým rizikem pro United States vojenské síly;
- určení ze strany sekretářka že existuje stav nouze v oblasti veřejného zdraví nebo významný potenciál pro nouzovou situaci v oblasti veřejného zdraví, která ovlivňuje nebo má významný potenciál ovlivnit národní bezpečnost nebo zdraví a bezpečnost Spojených států States občané žijící v zahraničí, a to zahrnuje biologické, chemické, radiologické nebo jaderné činitele nebo činitele nebo onemocnění nebo stav, který lze připsat takovému činiteli nebo činitelům; nebo
- identifikaci věcné hrozby podle § 319F–2 zákona č Zákon o ochraně veřejného zdraví [42 USC 247d–6b] dostatečné k ovlivnění národní bezpečnosti nebo zdraví a bezpečnosti United States občanů žijících v zahraničí.
Nikde v těchto čtyřech situacích není žádná zmínka o přirozeně se vyskytující epidemii, pandemii nebo jiném druhu situace v oblasti veřejného zdraví, která není způsobena „biologickými, chemickými, radiologickými nebo jadernými látkami“.
Mohl by se SARS-CoV-2 kvalifikovat jako takový agent?
Pokud hledáte definici „biologické prostředky“ v americkém právním kodexu půjdete následujícím způsobem:
Zločiny a trestní řízení -> Zločiny -> Biologické zbraně -> Definice
V kontextu práva Spojených států tedy termín „biologické látky“ znamená biologické zbraně a použití takových látek/zbraní je považováno za zločin.
Wikipedia to poskytuje definice:
Biologický prostředek (také nazývaný bio-agent, biologický prostředek ohrožení, biologický válečný prostředek, biologická zbraň nebo biologická zbraň) je bakterie, virus, prvoky, parazit, houbanebo toxin, který lze účelně použít jako zbraň bioterorismu or biologická válka (BW).
Na jakém právním základě byla vydána EUA pro vakcíny Covid mRNA?
Na základě zákonů týkajících se EUA by se zdálo, že žádná ze čtyř možných situací popsaných v zákoně nemůže být aplikována na produkt určený k prevenci nebo léčbě onemocnění způsobeného přirozeně se vyskytujícím patogenem.
Přesto byl tento zákon použit k autorizaci vakcín mRNA Covid.
Vzhledem ke čtyřem možnostem uvedeným v zákoně EUA byla ta, která byla použita pro „protiopatření“ Covid
C) určení ze strany sekretářka že existuje stav nouze v oblasti veřejného zdraví nebo významný potenciál pro nouzovou situaci v oblasti veřejného zdraví, která ovlivňuje nebo má významný potenciál ovlivnit národní bezpečnost nebo zdraví a bezpečnost Spojených států States občané žijící v zahraničí, a to zahrnuje biologické, chemické, radiologické nebo jaderné činitele nebo činitele nebo onemocnění nebo stav, který lze připsat takovému činiteli nebo činitelům.
Kdy aplikované konkrétně na Covid, bylo to formulováno takto:
tajemník ministerstva zdravotnictví a sociálních služeb (HHS) rozhodl, že existuje mimořádná situace v oblasti veřejného zdraví, která má významný potenciál ovlivnit národní bezpečnost nebo zdraví a bezpečnost občanů Spojených států žijících v zahraničí, a která zahrnuje virus způsobující koronavirus Nemoc 2019 (COVID-19)…
Není pochyb o tom, že „virus, který způsobuje COVID-19“ je považován za ekvivalent „biologické, chemické, radiologické nebo jaderné látky nebo látek“.
Je také důležité poznamenat, že EUA „určení stavu nouze v oblasti veřejného zdraví“ je zcela oddělené od jakýchkoli jiných prohlášení o nouzi v oblasti veřejného zdraví, jako jsou ta, která vydala WHO, vláda USA, a žádným způsobem se na ně nespoléhá. a prezident na začátku pandemie Covid-19.
Takže i když WHO, vláda USA a prezident prohlásí, že pandemie skončila, stále může existovat povolení k nouzovému použití, pokud ministr HHS bude nadále tvrdit, že situace popsaná v části C) existuje.
Při pohledu na všechny EUA pro stovky zdravotnických produktů souvisejících s Covidemje velmi obtížné pochopit, jak by sekretář HHS mohl ospravedlnit tvrzení, že „existuje mimořádná situace v oblasti veřejného zdraví, která má významný potenciál ovlivnit národní bezpečnost nebo zdraví a bezpečnost občanů USA žijících v zahraničí“ ve většině, ne-li ve všech, těchto případů.
Další „zákonná kritéria“ pro udělení povolení k nouzovému použití FDA
Jakmile tajemník HHS prohlásí, že existuje stav nouze pro veřejné zdraví, který zaručuje EUA, na základě jedné ze čtyř situací uvedených v zákoně, existují čtyři další „statutární kritéria“, která musí být splněna, aby FDA vydal EUA. . Zde je návod, jak FDA vysvětluje tyto požadavky:
- Závažná nebo život ohrožující nemoc nebo stav
Aby FDA mohl vydat EUA, musí být CBRN agent(é) uvedený v prohlášení EUA tajemníka HHS schopen způsobit vážné nebo život ohrožující onemocnění nebo stav.
POZNÁMKA: Toto kritérium opakuje specifikaci CBRN agenta, který je právně definován jako zbraň použitá při páchání trestného činu.
- Důkaz účinnosti
Lékařské produkty, které mohou být zvažovány pro EUA, jsou ty, které „mohou být účinné“ k prevenci, diagnostice nebo léčbě závažných nebo život ohrožujících onemocnění nebo stavů, které mohou být způsobeny látkou (látkami) CBRN uvedenými v prohlášení tajemníka HHS o stav nouze nebo ohrožení nouze podle § 564 písm. b).
Norma „může být účinná“ pro EUA poskytuje nižší úroveň důkazů než norma „účinnosti“, kterou FDA používá pro schvalování produktů. FDA má v úmyslu posoudit potenciální účinnost možného produktu EUA případ od případu pomocí analýzy rizika a přínosu, jak je vysvětleno níže.
[Přidána BOLDFACE]
PRÁVNÍ OTÁZKA: Jak může někdo právně tvrdit, že produkt autorizovaný podle EUA je „bezpečný a účinný“, pokud právní norma pro EUA je „může být účinná“ a FDA prohlašuje, že jde o „nižší úroveň důkazů“ než používaná norma pro pravidelné schvalování produktů?
- Analýza rizika a přínosu
Produkt může být považován za EUA, pokud komisař rozhodne, že známé a potenciální přínosy produktu při použití k diagnostice, prevenci nebo léčbě identifikovaného onemocnění nebo stavu převažují nad známými a potenciálními riziky produktu.
Při určování, zda známé a potenciální přínosy produktu převažují nad známými a potenciálními riziky, FDA se hodlá podívat na základě souhrnu vědeckých důkazů k celkovému stanovení rizika a přínosu. Takový důkaz, který mohl vzniknout z různých zdrojů, může zahrnovat (ale není omezeno na): výsledky domácích a zahraničních klinických studií, údaje o účinnosti in vivo ze zvířecích modelů a údaje in vitro, k dispozici pro posouzení FDA. FDA také posoudí kvalitu a množství dostupné důkazy, vzhledem k současnému stavu vědeckého poznání.
[Přidána BOLDFACE]
PRÁVNÍ POZNÁMKA: Neexistuje žádná právní norma a neexistují žádné právní definice toho, co znamená, že „známé a potenciální přínosy“ převažují nad „známými a potenciálními riziky“. Neexistuje také žádná kvalitativní nebo kvantitativní právní definice toho, co představuje přijatelné „dostupné důkazy“, na nichž „může být“ založena analýza rizika a přínosu. Mohlo by existovat nula skutečných důkazů, ale přesvědčení, že produkt má mnoho potenciálních přínosů a ne mnoho potenciálních rizik, a to by splnilo tento „zákonný požadavek“.
- Žádné alternativy
Aby FDA vydala EUA, nesmí existovat žádná adekvátní, schválená a dostupná alternativa ke kandidátskému produktu pro diagnostiku, prevenci nebo léčbu onemocnění nebo stavu. Potenciální alternativní produkt může být považován za „nedostupný“, pokud nejsou dostatečné zásoby schválené alternativy k plnému pokrytí nouzové potřeby.
PRÁVNÍ DOTAZ: Kromě nehorázného a potenciálně kriminálního znevažování/nezákonnosti alternativní léčby Covid-19, jako je ivermektin a hydroxychlorochin, v jakém okamžiku existovala schválená alternativa pro „prevenci Covid-19“ (jediná věc, kvůli které byly zakoupeny vakcíny mRNA? ) – Paxlovid, například – což by způsobilo, že EUA pro mRNA vakcíny již nejsou legální?
Zde je návod, jak byla všechna tato „zákonná kritéria“ splněna ve skutečnosti Povolení k nouzovému použití pro mRNA vakcíny BioNTEch/Pfizer Covid:
Dospěl jsem k závěru, že nouzové použití vakcíny Pfizer-BioNtech COVID-19 k prevenci COVID-19, pokud je podávána tak, jak je popsáno v rozsahu oprávnění (oddíl II), splňuje kritéria pro vydání povolení podle § 564 písm. zákona, protože:
- SARS-CoV-2 může u lidí infikovaných tímto virem způsobit vážné nebo život ohrožující onemocnění nebo stav, včetně závažného respiračního onemocnění;
- Na základě souhrnu vědeckých důkazů dostupných FDA je rozumné se domnívat, že vakcína Pfizer-BioNtech COVID-19 může být účinná v prevenci COVID-19a že při použití za podmínek popsaných v tomto povolení jsou známé a potenciální přínosy vakcíny Pfizer-BioNtech COVID-19 při použití k prevenci COVID-19 převáží jeho známá a potenciální rizika; a
- Neexistuje žádná adekvátní, schválená a dostupná alternativa k nouzovému použití vakcíny Pfizer-BioNtech COVID-19 k prevenci COVID-19.
[Přidána BOLDFACE]
POZNÁMKA: Jediný kontext, ve kterém FDA zvažoval potenciální přínosy a rizika vakcíny a ve kterém FDA rozhodl, že „může být účinná“, byl v prevenci Covid-19.
Neexistuje žádná úvaha, žádný důkaz o skutečném nebo potenciálním přínosu a žádné určení, že existuje nějaká potenciální účinnost vakcíny dělat něco jiného, včetně: snížení rizika závažného onemocnění, snížení rizika hospitalizace, snížení rizika úmrtí , což snižuje riziko jakýchkoli stavů, které skutečně nebo potenciálně souvisí s Covid-19.
PROTO by se dalo rozumně zpochybnit zákonnost jakýchkoli tvrzení, že vakcína je „bezpečná a účinná“ v kontextu čehokoli jiného než „když je použita k prevenci COVID-19“ – o čemž bylo známo, že vakcíny NEDĚLAJÍ velmi brzy poté, co byly představil.
Pokud by se lidem řeklo, že mRNA vakcíny BioNTech/Pfizer jsou „bezpečné a účinné“ v čemkoli jiném než v prevenci Covid-19, a pokud by jim hrozily jakékoli důsledky za to, že vakcínu nevzali kvůli něčemu jinému než kvůli prevenci Covid-19, mohli by mají legitimní argument, že byli nezákonně donuceni vzít neschválený produkt na základě podvodných tvrzení?
Požadavky třetí úrovně pro EUA pro neschválené produkty
Jakmile budeme mít prohlášení o nouzi specifické pro EUA a jakmile FDA prohlásí, že produkt může být účinný a že jakýkoli dostupný důkaz (od nuly do nekonečna) ukazuje, že jeho přínosy převažují nad riziky (jak je stanoveno podle toho, co si FDA myslí, že by mohly be), existuje ještě jedna vrstva regulace nesouvisející s bezpečností a nesouvisející s účinností.
Zde je návod, jak a Zpráva Kongresové výzkumné služby o EUA za rok 2018 vysvětluje toto:
FFDCA § 564 nařizuje FDA uložit určité požadované podmínky v EUA a v případě potřeby umožňuje dodatečné diskreční podmínky. Požadované podmínky se liší v závislosti na tom, zda je EUA pro neschválený produkt nebo pro neschválené použití schváleného produktu. U neschváleného produktu musí podmínky použití:
(1) zajistit, aby zdravotničtí pracovníci podávající přípravek obdrželi požadované informace;
(2) zajistit, aby jednotlivci, kterým je přípravek podáván, obdrželi požadované informace;
3) zajistit sledování a hlášení nežádoucích účinků spojených s přípravkem; a
4) zajistit vedení záznamů a podávání zpráv výrobcem.
PRÁVNÍ OTÁZKA: Co přesně jsou „požadované informace“? Víme, že lidé byli informováni, že vakcínám bylo uděleno povolení k nouzovému použití. Bylo jim však řečeno, že to znamená „nižší úroveň důkazů“, než je vyžadováno pro tvrzení o „bezpečnosti a účinnosti“ na jiných lékařských produktech? Byli informováni, že existují různé úrovně „bezpečnosti a účinnosti“ v závislosti na tom, zda má produkt povolení EUA nebo jiný typ?
POZNÁMKA: Zákon vyžaduje, aby existoval způsob sledování a hlášení nežádoucích příhod. Neuvádí však, kdo monitoruje, jaké jsou standardy pro podávání zpráv a jaká je hranice pro přijetí opatření na základě zpráv.
EUA ve srovnání s každou jinou cestou schvalování léků/vakcín
Jako badatel/spisovatel Saša Latypová poukázal na to, že mnoho lidí bylo zmateno EUA, protože to zní hodně jako EAU, což znamená „Expanded Access Use“. Jedná se o typ povolení uděleného léčivým přípravkům, pokud je naléhavě potřeba konkrétní skupinou pacientů (např. pacienti s rakovinou stadia IV, jejichž očekávaná délka života se měří v měsících), kteří jsou ochotni riskovat nežádoucí příhody a dokonce smrt výměnou za přístup. k experimentální léčbě.
Oprávnění k nouzovému použití v žádném případě nesouvisí s Rozšířeným přístupem a ani se mu nijak nepodobá.
Různé právní cesty pro povolování léčivých přípravků jsou přehledně uvedeny v tabulce, kterou zdůraznil právní výzkumník Katherine Watt. Tabulka je součástí prezentace v roce 2020 na společném vzdělávacím zasedání FDA-CDC: Regulační aktualizace o používání lékařských protiopatření.
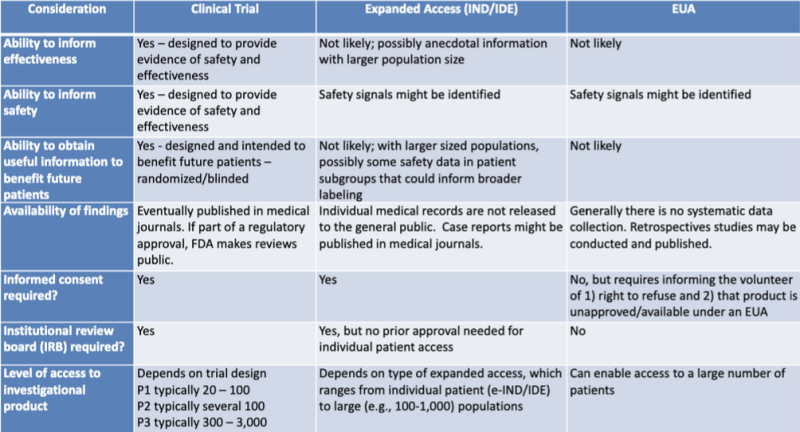
Tato tabulka velmi jasně ukazuje, že proces EUA pravděpodobně neposkytne informace o účinnosti produktu, není navržen tak, aby poskytoval důkazy o bezpečnosti, pravděpodobně neposkytne užitečné informace ve prospěch budoucích pacientů, nezahrnuje žádný systematický sběr dat, nevyžaduje žádné retrospektivní studie, žádný informovaný souhlas a žádná institucionální kontrolní komise.
Navíc v a Publikace Institutu medicíny Národní akademické publikace z roku 2009, také zdůraznil Watt, s názvem „Medical Countermeasures: Dispensing Emergency Use Authorization and the Postal Model – Workshop Summary“ najdeme toto prohlášení na str. 28:
Je důležité si uvědomit, že EUA není součástí cesty rozvoje; jedná se o zcela samostatný subjekt, který se používá pouze v mimořádných situacích a není součástí procesu schvalování léčiv.
Znamená to, že schválení protiopatření Covid-19, která byla založena na povolenkách EUA, bylo nezákonné? Znamená to, že neexistuje žádný zákonný způsob, jak prohlásit, že produkt EUA je „bezpečný a účinný“, protože NENÍ SOUČÁSTÍ PROCESU SCHVÁLENÍ LÉČIV?
Proč investovat do čističky vzduchu?
Vzhledem ke všem informacím v tomto článku a v předchozím je to eminentně zřejmé Část 1že mRNA vakcíny BioNTach/Pfizer Covid byly vyvinuty, vyrobeny a autorizovány podle vojenských zákonů vyhrazených pro mimořádné situace zahrnující biologickou válku/terorismus, nikoli přirozeně se vyskytující nemoci postihující celou civilní populaci.
Dodržování předpisů a dohled, které očekáváme, když je výrobek považován za „bezpečný a účinný“ pro celou civilní populaci, proto nebylo ze zákona vyžadováno.
Lze tuto analýzu použít ke zpochybnění zákonnosti „bezpečného a účinného“ tvrzení vládních úředníků, kteří věděli, co EUA obnáší? Existují další právní důsledky?
Doufám.
Důležité je, že u dosud předložených právních námitek proti Covid mRNA vakcínám neexistovala žádná rozhodnutí (která jsem si vědoma), zda lze vojenské právo, jako OTA a EUA, aplikovat na civilní situace. Nicméně, tam bylo prohlášení soudce okresního soudu Michael Truncale, v jeho zamítnutí případu oznamovatele Brook Jackson versus Ventavia a Pfizer, to je důležité mít na paměti.
Zde soudce uznává, že dohoda o mRNA vakcínách BioNTech/Pfizer byla vojenskou OTA, ale odmítá rozhodnout o její použitelnosti na nevojenské okolnosti (přirozeně se vyskytující onemocnění, 100 milionů dávek většinou ne pro vojenské použití), za kterých bylo vydáno:
Skutečnost, že vakcínu dostali jak vojenský personál, tak civilisté, neznamená, že získání vakcíny bylo irelevantní pro zvýšení efektivity vojenské mise. Ještě důležitější je, že paní Jackson ve skutečnosti žádá tento soud, aby zrušil rozhodnutí ministerstva obrany uplatňovat jiný orgán pro transakce k nákupu vakcíny Pfizer. Ale jak Nejvyšší soud Spojených států dlouho zdůrazňoval, „složitá rafinovaná a profesionální rozhodnutí, pokud jde o složení, výcvik, vybavení a kontrolu vojenských sil, jsou v podstatě profesionálními vojenskými rozhodnutími“. Gilligan v. Morgan, 413 US 1, 10 (1973). Je tedy „obtížné představit si oblast vládní činnosti, ve které mají soudy menší pravomoci“. Id. Tento soud nebude vetovat rozsudky ministerstva obrany týkající se účinnosti mise během národní nouze.
Toto je jen jedna z mnoha právních překážek, které zůstávají v boji za to, aby byly všechny produkty mRNA schválené během nouzového stavu Covid-19 a jakékoli následné produkty mRNA, jejichž schválení bylo založeno na schvalovacím procesu Covid-19, postaveny mimo zákon.
Publikováno pod a Mezinárodní licence Creative Commons Attribution 4.0
Pro dotisky nastavte kanonický odkaz zpět na originál Brownstone Institute Článek a autor.









