Během pandemie Covid utratila americká vláda miliardy dolarů za téměř 400 produktů určených k ochraně, diagnostice a léčbě stovek milionů lidí – všechny s označením „EUA“ nebo „Emergency Use Authorization“.
Co ale EUA vlastně znamená?
Ještě předtím, než na tuto otázku odpovíme, a abychom pochopili, kde EUA stojí ve vztahu k jiným cestám pro povolování nebo schvalování léčivých přípravků, je užitečné podívat se na co EUA není:
EUA není označení pro experimentální produkt procházející klinickým hodnocením
Pokud o EUA rozumíme pouze jedné věci, mělo by to být toto: EUA se nevztahuje na produkt procházející klinickým hodnocením, který se řídí předpisy FDA nebo jinými právními požadavky.
EUA také není totéž jako rozšířené používání přístupu (EAU), často nazývané „použití ze soucitu“, které se vztahuje na poskytování přístupu pacientům s těžkými, nevyléčitelnými chorobami k experimentálním produktům před jejich úplným schválením.
Tato tabulka od an Prezentace FDA-CDC 2020 shrnuje rozdíly mezi produkty procházejícími klinickými testy, produkty podávanými pacientům prostřednictvím rozšířeného „soucitného“ přístupu a produkty autorizovanými prostřednictvím EUA:
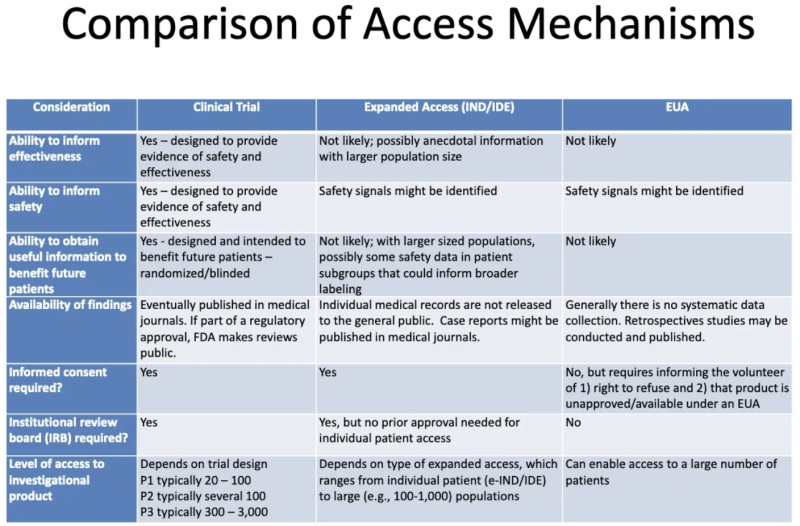
Tato tabulka nám o EUA říká:
- Proces udělování povolenek EUA pravděpodobně nevygeneruje žádné informace o účinnosti produktu.
- Proces udělování EUA není navržen tak, aby poskytoval důkazy o bezpečnosti nebo účinnosti, ale bezpečnostní signály mohou být identifikovány.
- Je nepravděpodobné, že jakmile bude produktu udělena EUA a bude podán některým pacientům, budou získány nějaké užitečné informace pro budoucí pacienty.
- Neexistuje žádný systematický sběr dat o účinnosti nebo bezpečnosti s EUA a žádná data nejsou publikována v lékařských časopisech jako součást regulačního schvalovacího procesu.
- Není vyžadován žádný informovaný souhlas, ale pacientům, kteří se „dobrovolně“ přihlásí k užívání produktu, musí být sděleno, že mohou odmítnout a že produkt není schválen/dostupný podle EUA.
- Není vyžadována žádná institucionální kontrolní komise (IRB). [IRB je deska, která má chránit blaho lidských subjektů v klinických studiích]
Abychom ještě více objasnili, jak jsou povolenky oddělené od jakéhokoli normálního schvalovacího procesu, v a Publikace Institutu medicíny národních akademií z roku 2009, najdeme toto prohlášení:
Je důležité si uvědomit, že EUA není součástí cesty rozvoje; jedná se o zcela samostatný subjekt, který se používá pouze v mimořádných situacích a není součástí procesu schvalování léčiv. (str. 28)
Abychom to shrnuli:
Je nepravděpodobné, že by proces udělování EUA produktu přinesl jakýkoli důkaz o bezpečnosti nebo účinnosti. Jakmile je produktu udělena EUA a je podán pacientům, je nepravděpodobné, že budou získány nějaké užitečné informace pro budoucí pacienty, protože neexistuje systematický sběr údajů o účinnosti nebo bezpečnosti.
Na základě všech těchto velmi jasných informací od CDC/FDA a IMNA by bylo spravedlivé dojít k závěru, že povolení k nouzovému použití je proces, který by měl být uplatňován velmi uvážlivě a pouze v případech naléhavých případů.
Nyní se podívejme na to, jaké typy nouzových situací jsou EUA právně určeny k řešení.
EAU je určena pro nouzové situace se zbraněmi hromadného ničení
Výše popsané zákony povolující „přístupový mechanismus EUA“ byly vypracovány pro případy extrémních, bezprostředních mimořádných událostí zahrnujících zbraně hromadného ničení (ZHN), označované také jako CBRN (chemické, biologické, radiologické, jaderné) látky.
Zde je návod, jak Food & Drug Administration (FDA) popisuje své EUA pravomoci:
§ 564 zákona FD&C (21 U.S.C. 360 bb–3) umožňuje FDA posílit ochranu veřejného zdraví proti biologickým, chemickým, jaderným a radiologickým látkám.
S touto autoritou EUA může FDA pomoci zajistit, že lékařská protiopatření mohou být použita v naléhavých případech k diagnostice, léčbě nebo prevenci závažných nebo život ohrožujících onemocnění nebo stavů způsobených biologickými, chemickými, nukleárními nebo radiologickými látkami, pokud neexistují adekvátní, schválená a dostupné alternativy (kromě jiných kritérií).
Tyto pravomoci EUA byly uděleny v roce 2004 za velmi specifických okolností souvisejících s připraveností na útoky CBRN agentů.
Jak bylo vysvětleno v Harvard Law’s Bill of Health,
Nakonec to byla válka proti terorismu, která dala vzniknout povolení k nouzovému použití. Po událostech z 11. září 2001 a následných antraxových poštovních útocích Kongres uzákonil Project Bioshield Act z roku 2004.
Projekt záznam naznačuje, že Kongres se zaměřil konkrétně na hrozbu bioteroru, nikoli na přípravu na přirozeně se vyskytující pandemii.
Vzhledem k tak úzkému typu skutečně extrémní mimořádné situace zahrnující útok ZHN je pochopitelné, proč „mechanismus přístupu“ k EUA nevyžaduje velký regulační dohled nebo dodržování jakýchkoli standardů výroby nebo klinických zkoušek.
Co tedy mechanismus přístupu k EUA vlastně vyžaduje?
3 kroky pro povolení k nouzovému použití (EUA)
Aby mohly být uděleny EUA lékařskému produktu, musí se stát tři věci:
- Ministr pro vnitřní bezpečnost, ministr obrany nebo ministr zdravotnictví a sociálních služeb musí určit, že došlo k mimořádné události zahrnující útok nebo hrozbu útoku s CBRN agentem nebo nemoc způsobenou takovým agentem.
- FDA se musí ujistit, že při vydávání EUA splňuje čtyři „statutární kritéria“.
- FDA musí v EUA „zavést určité požadované podmínky“.
EUA Krok 1: Vyhlášení CBRN nouze
Vyhlášení nouze pro EUA je samostatné a nesouvisí s žádnými jinými prohlášeními o nouzi, které může vydat prezident, tajemník HHS nebo kdokoli jiný. Musí být vydána speciálně za účelem aktivace EUA a může být ukončena nebo prodloužena nezávisle na jakémkoli jiném nouzovém prohlášení.
Tady je co uvádí zákon EUA jsou čtyři možné scénáře pro aktivaci „mechanismu přístupu k EUA“:
- rozhodnutí ministra pro vnitřní bezpečnost, že existuje domácí nouzový stav nebo významný potenciál pro domácí nouzový stav, který zahrnuje zvýšené riziko útoku biologickým, chemickým, radiologickým nebo jaderným činitelem nebo látkami;
- rozhodnutí ministra obrany, že existuje vojenská mimořádná situace nebo významný potenciál pro vojenskou mimořádnou událost, která zahrnuje zvýšené riziko pro Sjednocený States vojenské síly, včetně personálu působícího pod pravomocí hlavy 10 nebo hlavy 50, zaútočí s —
- biologické, chemické, radiologické nebo jaderné činidlo nebo činidla; nebo
- agent nebo agenti, kteří mohou způsobit nebo jsou jinak spojeni s bezprostředně život ohrožujícím a specifickým rizikem pro United States vojenské síly;
- určení ze strany sekretářka [zdravotních a sociálních služeb], že došlo k ohrožení veřejného zdraví nebo k významnému potenciálu ohrožení veřejného zdraví, který ovlivňuje nebo má významný potenciál ovlivnit národní bezpečnost nebo zdraví a bezpečnost Sjednocený States občané žijící v zahraničí, a to zahrnuje biologické, chemické, radiologické nebo jaderné činitele nebo činitele nebo onemocnění nebo stav, který lze připsat takovému činiteli nebo činitelům; nebo
- identifikaci věcné hrozby podle § 319F–2 zákona č Zákon o ochraně veřejného zdraví [42 USC 247d–6b] dostatečné k ovlivnění národní bezpečnosti nebo zdraví a bezpečnosti Sjednocený States občanů žijících v zahraničí.
EUA Krok 2. Splnění statutárních kritérií
Jakmile jeden z tajemníků prohlásí, že existuje nouzový stav, který zaručuje EUA, existují čtyři další „statutární kritéria“, která musí být splněna, aby FDA vydal EUA. Zde je návod, jak FDA vysvětluje tyto požadavky:
- Závažná nebo život ohrožující nemoc nebo stav
Aby FDA mohl vydat EUA, musí být CBRN agent(é) uvedený v prohlášení EUA tajemníka HHS schopen způsobit vážné nebo život ohrožující onemocnění nebo stav.
- Důkaz účinnosti
Lékařské produkty, které mohou být zvažovány pro EUA, jsou ty, které „mohou být účinné“ k prevenci, diagnostice nebo léčbě závažných nebo život ohrožujících onemocnění nebo stavů, které mohou být způsobeny látkou (látkami) CBRN uvedenými v prohlášení tajemníka HHS o stav nouze nebo ohrožení nouze podle § 564 písm. b).
Norma „může být účinná“ pro EUA poskytuje nižší úroveň důkazů než norma „účinnosti“, kterou FDA používá pro schvalování produktů. FDA má v úmyslu posoudit potenciální účinnost možného produktu EUA případ od případu pomocí analýzy rizika a přínosu, jak je vysvětleno níže.
[Přidána BOLDFACE]
- Analýza rizika a přínosu
Produkt může být považován za EUA, pokud komisař rozhodne, že známé a potenciální přínosy produktu při použití k diagnostice, prevenci nebo léčbě identifikovaného onemocnění nebo stavu převažují nad známými a potenciálními riziky produktu.
Při určování, zda známé a potenciální přínosy produktu převažují nad známými a potenciálními riziky, FDA se hodlá podívat na základě souhrnu vědeckých důkazů k celkovému stanovení rizika a přínosu. Takový důkaz, který mohl vzniknout z různých zdrojů, může zahrnovat (ale není omezeno na): výsledky domácích a zahraničních klinických studií, údaje o účinnosti in vivo ze zvířecích modelů a údaje in vitro, k dispozici pro posouzení FDA. FDA také posoudí kvalitu a množství dostupné důkazy, vzhledem k současnému stavu vědeckého poznání.
[Přidána BOLDFACE]
- Žádné alternativy
Aby FDA vydal EUA, nesmí existovat žádná adekvátní, schválená a dostupná alternativa ke kandidátskému produktu pro diagnostiku, prevenci nebo léčbu onemocnění nebo stavu. Potenciální alternativní produkt může být považován za „nedostupný“, pokud nejsou dostatečné zásoby schválené alternativy k plnému pokrytí nouzové potřeby.
EUA Krok 3. Uložení požadovaných podmínek
Jakmile budeme mít nouzovou deklaraci specifickou pro EUA a jakmile FDA rozhodne, že produkt může být účinný a že jakékoli dostupné důkazy ukazují, že jeho přínosy převažují nad riziky, existuje ještě jedna vrstva související regulace.
Zde je návod, jak a Zpráva Kongresové výzkumné služby o EUA za rok 2018 vysvětluje toto:
FFDCA § 564 nařizuje FDA uložit určité požadované podmínky v EUA a v případě potřeby umožňuje dodatečné diskreční podmínky. Požadované podmínky se liší v závislosti na tom, zda je EUA pro neschválený produkt nebo pro neschválené použití schváleného produktu. U neschváleného produktu musí podmínky použití:
(1) zajistit, aby zdravotničtí pracovníci podávající přípravek obdrželi požadované informace;
(2) zajistit, aby jednotlivci, kterým je přípravek podáván, obdrželi požadované informace;
3) zajistit sledování a hlášení nežádoucích účinků spojených s přípravkem; a
(4) zajistit vedení záznamů a podávání zpráv výrobcem.
Proč investovat do čističky vzduchu?
Jak je uvedeno v tomto článku, FDA/CDC jasně uznává, že proces udělování povolení k nouzovému použití (EUA) pravděpodobně nevygeneruje žádné informace o účinnosti nebo bezpečnosti produktu. Když se podíváme na literu zákona upravující EUA, vidíme, že je to skutečně správné posouzení.
Zákon EUA neukládá žádné právní nebo regulační normy, které by mohly určovat, zda je produkt bezpečný nebo účinný. Jedinými standardy je, zda FDA věří, že produkt může být účinný a že jeho známé přínosy převažují nad známými škodami. Pokud nejsou známy žádné škody nebo známé přínosy, protože produkt nikdy neprošel procesem schvalování léčiv, může FDA použít jakékoli informace nebo standardy, které si vybere, aby učinil toto rozhodnutí.
Z toho všeho vyplývá, že společnost, jejíž produkt je kandidátem na EUA, se může pokusit prokázat bezpečnost a/nebo účinnost produktu jakýmikoli prostředky, které zvolí. Existence takového pokusu (ať už jde o klinickou studii nebo jiný mechanismus sběru dat) a způsob, jakým je tento pokus veden, závisí na společnosti. Nic v zákoně EUA se nevztahuje na to, jak společnost navrhuje, provádí nebo analyzuje jakékoli studie nebo jiné mechanismy sběru dat, které se rozhodne provádět.
Aplikováno na produkty Covid to znamená:
- Aby produkty Covid mohly získat EUA, nebyly vyžadovány žádné údaje o bezpečnosti nebo účinnosti z klinických studií.
- Jakékoli klinické studie uvedené v procesu EUA byly provedeny bez legálně platných regulačních norem.
- Když zjistíme, že tyto produkty postrádají účinnost nebo bezpečnost, není to překvapení. Je to vysoce pravděpodobný výsledek procesu.
- Neexistují žádná data z procesu EUA, na kterých by bylo možné založit rozhodnutí, která nejsou EUA o bezpečnosti nebo účinnosti produktu. Jakékoli použití produktu bez EUA by tedy vyžadovalo od začátku projít zákonným schvalovacím procesem pro běžné lékařské produkty.
Více o schvalovacím procesu pro vakcíny Covid zde.
Znovu publikováno od autora Náhradník
Publikováno pod a Mezinárodní licence Creative Commons Attribution 4.0
Pro dotisky nastavte kanonický odkaz zpět na originál Brownstone Institute Článek a autor.









